
U1287 – Institut Gustave Roussy
Cellules souches hématopoïétiques et développement des hémopathies myéloïdes
Au sommet du tissu hématopoïétique, les cellules souches hématopoïétiques (CSH) s’auto-renouvellent et donnent naissance à toutes les lignées de cellules sanguines. Les mécanismes étroitement régulés impliqués dans l’hématopoïèse normale incluent un certain nombre de facteurs intrinsèques, tels que les facteurs de transcription et les marques épigénétiques, et des facteurs extrinsèques, tels que les cellules de la niche et les cytokines qu’elles produisent.
Le système hématopoïétique est soumis à de nombreux changements tout au long de la vie. Les CSH se développent dans des niches anatomiquement distinctes, migrant pendant l’embryogenèse de la région aorte-gonades-mésonéphros (AGM) vers le foie fœtal et enfin vers la moelle osseuse, où la plupart des CSH résident tout au long de la vie adulte. Contrairement aux CSH de la moelle osseuse chez l’adulte, qui sont pour la plupart au repos, les CSH du foie fœtal sont hautement prolifératives. Des changements ontogéniques se produisent également dans différentes lignées. Par exemple, dans la lignée des mégacaryocytes (MK), certaines observations suggèrent que les MKs, ainsi que les plaquettes, embryonnaires et fœtaux pourraient avoir des propriétés et des fonctions spécifiques. Les thrombocytopénies héréditaires et les néoplasmes myéloprolifératifs (NMP) pourraient toucher non seulement l’hématopoïèse adulte mais également l’hématopoïèse embryonnaire / fœtale, y compris l’hématopoïèse primitive.
De l’autre côté de l’échelle de temps, le système hématopoïétique vieillissant subit de nombreux changements, notamment une augmentation du nombre de cellules myéloïdes et une diminution de la réponse immunitaire adaptative. Des anomalies clonales, appelées « hématopoïèse clonale liée à l’âge » peuvent se développer et créer un état pré-leucémique favorisant l’apparition de tumeurs malignes myéloïdes telles que les syndromes myélodysplasiques (MDS) et les NPM. Les manifestations phénotypiques du vieillissement hématopoïétique normal et pathologique peuvent également refléter des altérations des cellules hématopoïétiques différenciées.
L’unité est constituée des équipes suivantes :
Equipe 1 : Françoise PORTEU
« Vieillissement du tissu hématopoïétique »
Equipe 2 : Isabelle PLO et Hana RASLOVA
« Des cellules souches hématopoïétiques aux mégacaryocytes »
Françoise Porteu DR INSERM
FRANCOISE.PORTEU@gustaveroussy.fr
Eric SOLARY PUPH (HDR)
Nathalie DROIN CR1 INSERM (HDR)
Emilie ELVIRA-MATELOT CRCN INSERM
Dorothée SELIMOGLU-BUET CRCN (INSERM)
Lucie LAPLANE CR2 CNRS
Aline RENNEVILLE PH/Chercheur (GR)
Richard DYUNGA TR INSERM
Margot MORABITO TR (RP/IGR)
Guillaume THOER TR (IGR)
Rabie CHELBIE Post-Doc (Inovarion)
Omar EL MAWAS Post-Doc
Karima NACIRI IE (Inovarion)
Donia HIDAOUI Thèse 4ième
Aygun IMANCI Thèse 3ième
Anne STOLZ Thèse 2ième
Valentine MARCHAND Thèse 2ième
Dana ALAWIEH Thèse 1ere
Anaïs LAMOUREUX Stage M2
Y. Pelinski, D. Hidaoui, A. Stolz, F. Hermetet, R. Chelbi, M. K. Diop, A. M. Chioukh, F. Porteu*, E. Elvira-Matelot*, NF-κB signaling controls H3K9me3 levels at intronic LINE-1 and hematopoietic stem cell genes in cis. Journal of Experimental Medicine. 219, e20211356 (2022).
Pronier E, Imanci A, Selimoglu-Buet D, Badaoui B, Itzykson R, Roger T, Jego C, Naimo A, Francillette M, Breckler M, Wagner-Ballon O, Figueroa ME, Aglave M, Gautheret D, Porteu F, Bernard OA, Vainchenker W, Delhommeau F, Solary E, Droin NM. Macrophage migration inhibitory factor is overproduced through EGR1 in TET2low resting monocytes. Commun Biol. 2022 Feb 3;5(1):110. doi: 10.1038/s42003-022-03057-w.
You X, Liu F, Binder M, Vedder A, Lasho TL, Wen Z, Gao X, Flietner E, Rajagopalan A, Zhou Y, Finke CM, Mangaonkar AA, Liao R, Kong G, Ranheim EA, Droin NM, Hunter AM, Nikolaev S, Balasis ME, Abdel-Wahab O, Levine RL, Will B, Nadiminti KVG, Yang DT, Geissler K, Solary E, Xu W, Padron E, Patnaik MM, Zhang J. Asxl1loss cooperates with oncogenic Nras in mice to reprogram immune microenvironment and drive leukemic transformation. Blood. 2021 Oct 26:blood.2021012519. doi: 10.1182/blood.2021012519.
Carr RM, Vorobyev D, Lasho T, Marks DL, Tolosa EJ, Vedder A, Almada LL, Yurcheko A, Padioleau I, Alver B, Coltro G, Binder M, Safgren SL, Horn I, You X, Solary E, Balasis ME, Berger K, Hiebert J, Witzig T, Buradkar A, Graf T, Valent P, Mangaonkar AA, Robertson KD, Howard MT, Kaufmann SH, Pin C, Fernandez-Zapico ME, Geissler K, Droin N, Padron E, Zhang J, Nikolaev S, Patnaik MM. RAS mutations drive proliferative chronic myelomonocytic leukemia via a KMT2A-PLK1 axis. Nat Commun. 2021 May 18;12(1):2901.
Sevin M, Debeurme F, Badel, Morabito M, Laplane L, Newman HL, Torres-Martin M, Yang Q, Badaoui B, Wagner-Ballon O, Saada V, Sélimoglu-Buet D, Kraus-Berthier L, Banquet S, Derreal A, Fenaux P, Itzykson R, Braun T, Etienne G, Berthon C, Thepot S, Kepp O, Kroemer G, Padron E, Figueroa ME, Droin N, Solary E. Cytokine-like protein 1-induced survival of monocytes suggests a combined strategy targeting MCL1 and MAPK in CMML. Blood. 2021 Jun 17;137(24):3390-3402.
Silvin A, Chapuis N, Dunsmore G, Goubet AG, Dubuisson A, Derosa L, Almire C, Hénon C, Kosmider O, Droin N, Rameau P, Catelain C, Alfaro A, Dussiau C, Friedrich C, Sourdeau E, Marin N, Szwebel TA, Cantin D, Mouthon L, Borderie D, Deloger M, Bredel D, Mouraud S, Drubay D, Andrieu M, Lhonneur AS, Saada V, Stoclin A, Willekens C, Pommeret F, Griscelli F, Ng LG, Zhang Z, Bost P, Amit I, Barlesi F, Marabelle A, Pène F, Gachot B, André F, Zitvogel L, Ginhoux F,* Fontenay M,* Solary E.* Elevated Calprotectin and Abnormal Myeloid Cell Subsets Discriminate Severe from Mild COVID-19. Cell. 2020 Sep 17;182(6):1401-1418.e18.
Coltro G, Mangaonkar AA, Lasho TL, Finke CM, Pophali P, Carr R, Gangat N, Binder M, Pardanani A, Fernandez-Zapico M, Robertson KD, Bosi A, Droin N, Vannucchi AM, Tefferi A, Hunter A, Padron E, Solary E, Patnaik MM. Clinical, molecular, and prognostic correlates of number, type, and functional localization of TET2 mutations in chronic myelomonocytic leukemia (CMML)-a study of 1084 patients. Leukemia. 2020 May;34(5):1407-1421.
Paoletti A, Allouch A, Caillet M, Saïdi H, Subra F, Nardacci R, Wu Q, Muradova Z, Voisin L, Raza SQ, Law F, Thoreau M, Dakhli H, Delelis O, Poirier-Beaudouin B, Dereuddre-Bosquet N, Le Grand R, Lambotte O, Saez-Cirion A, Pancino G, Ojcius DM, Solary E, Deutsch E, Piacentini M, Gougeon ML, Kroemer G, Perfettini JL. HIV-1 Envelope Overcomes NLRP3-Mediated Inhibition of F-Actin Polymerization for Viral Entry. Cell Rep. 2019 Sep 24;28(13):3381-3394.e7.
Bencheikh L, Diop MK, Rivière J, Imanci A, Pierron G, Souquere S, Naimo A, Morabito M, Dussiot M, De Leeuw F, Lobry C, Solary E,* Droin N.* Dynamic gene regulation by nuclear colony-stimulating factor 1 receptor in human monocytes and macrophages. Nat Commun. 2019 Apr 26;10(1):1935.
Barbieri, D., E. Elvira-Matelot, Y. Pelinski, L. Genève, B. de Laval, G. Yogarajah, C. Pecquet, S.N.Constantinescu, and F. Porteu. 2018. Thrombopoietin protects hematopoietic stem cells from retrotransposon-mediated damage by promoting an antiviral response. Journal of Experimental Medicine. 215:1463–1480. doi:10.1084/jem.20170997.
Sarasin A, Quentin S, Droin N, Sahbatou M, Saada V, Auger N, Boursin Y, Dessen P, Raimbault A, Asnafi V, Schmutz JL, Taïeb A, Menck CFM, Rosselli F, La Rochelle LD, Robert C, Sicre de Fontbrune F, Sébert M, Leblanc T, Kannouche P, De Botton S, Solary E, Soulier J. Familial predisposition to TP53/complex karyotype MDS and leukemia in DNA repair-deficient xeroderma pigmentosum. Blood. 2019 Jun 20;133(25):2718-2724.
Selimoglu-Buet D, Rivière J, Ghamlouch H, Bencheikh L, Lacout C, Morabito M, Diop M, Meurice G, Breckler M, Chauveau A, Debord C, Debeurme F, Itzykson R, Chapuis N, Willekens C, Wagner-Ballon O, Bernard OA, Droin N,* Solary E*. A miR-150 / TET3 pathway regulates the generation of mouse and human non-classical monocyte subset. Nat Commun. 2018 Dec 21;9(1):5455.
Lucas N, Duchmann M, Rameau P, Noël F, Michea P, Saada V, Kosmider O, Pierron G, Fernandez-Zapico ME, Howard MT, King RL, Niyongere S, Diop MK, Fenaux P, Itzykson R, Willekens C, Ribrag V, Fontenay M, Padron E, Soumelis V, Droin N, Patnaik MM, Solary E. Biology and prognostic impact of clonal plasmacytoid dendritic cells in chronic myelomonocytic leukemia. Leukemia. 2019 Oct;33(10):2466-2480.
Micol JB, Pastore A, Inoue D, Duployez N, Kim E, Lee SC, Durham BH, Chung YR, Cho H, Zhang XJ, Yoshimi A, Krivtsov A, Koche R, Solary E, Sinha A, Preudhomme C, Abdel-Wahab O. ASXL2 is essential for haematopoiesis and acts as a haploinsufficient tumour suppressor in leukemia. Nat Commun. 2017 May 18;8:15429.Deininger MWN, Tyner JW, Solary E. Turning the tide in myelodysplastic / myeloproliferative neoplasms. Nat Rev Cancer. 2017;17:425-440.
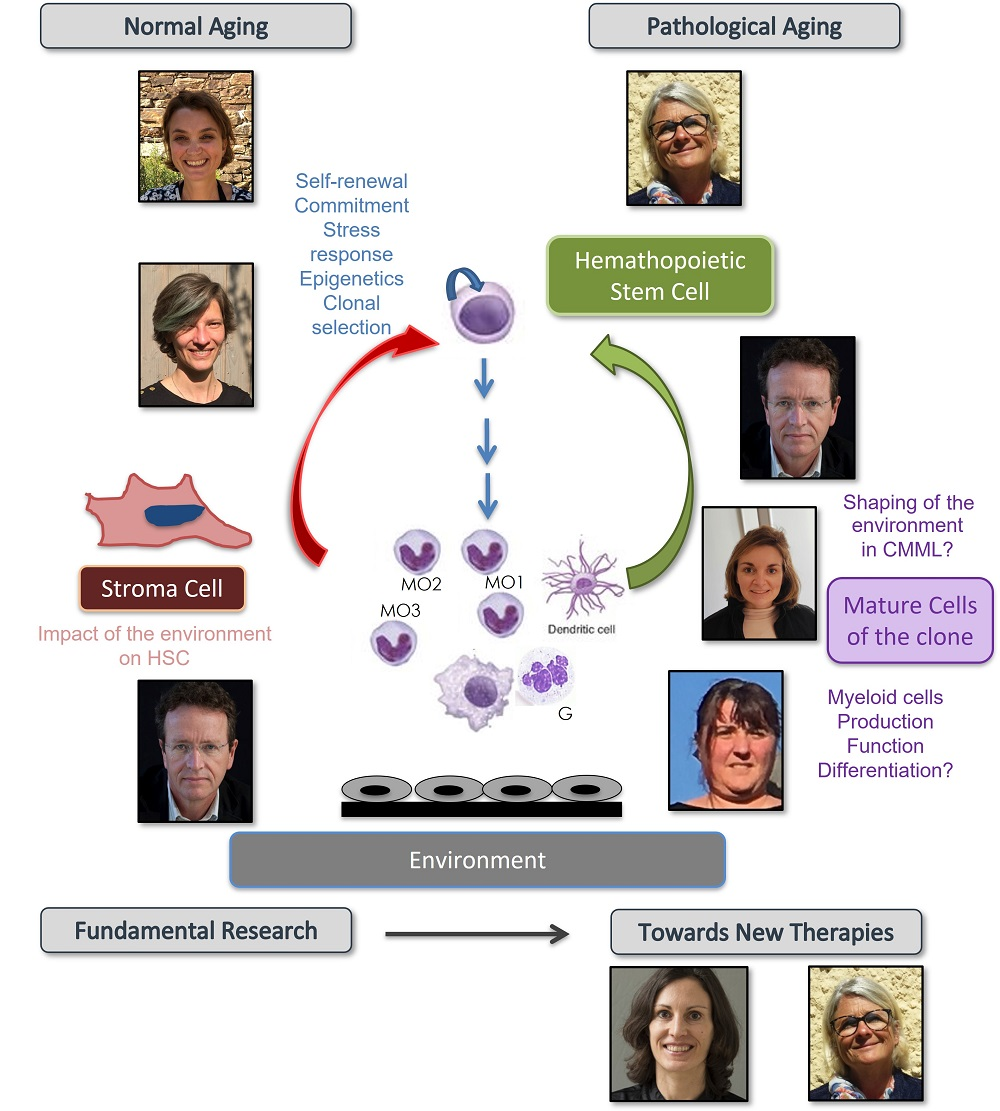
Le vieillissement du tissu hématopoïétique
La population mondiale vieillit. Cette évolution démographique suscite l’exploration approfondie des effets physiopathologiques du vieillissement, l’un d’entre eux étant l’émergence d’affections malignes. Le vieillissement du tissu hématopoïétique, par exemple, modifie la composition et les fonctions des cellules sanguines, altère l’immunité innée et adaptative, contribue à l’émergence de cytopénies isolées et de maladies chroniques, et prédispose au développement d’hémopathies malignes telles que syndromes myélodysplasiques (SMD), néoplasmes myéloproliféraifs (NMP), et leucémies aigües myéloïdes (LAM). L’étude de l’impact moléculaire, cellulaire et tissulaire du vieillissement devrait suggérer des stratégies de prévention et de détection précoce de ces maladies.
L’équipe explore l’impact du vieillissement sur la différenciation myélomonocytaire. Nous étudions les mécanismes moléculaires de la différenciation, à partir des cellules souches hématopoïétiques (CSH), des cellules de la lignée myélomonocytaire, avec un intérêt particulier pour la nature, la fonction, le devenir des différentes populations des monocytes matures. Notre programme vise à décrypter l’évolution des CSH et des cellules myéloïdes sous l’effet de variations intrinsèques (modifications géniques, dérégulation du génome non codant, évolution épigénétique) et extrinsèques, qu’il s’agisse des changements du microenvironnement ou de facteurs plus éloignés comme les variations dans la composition du microbiote. Nous explorons l’évolution de ces processus dans le contexte normal, au cours des stress et dans un contexte pathologique : la leucémie myélomonocytaire chronique (LMMC), une hémopathie myéloïde modèle car 1) typiquement associée au vieillissement 2) associant une composante dysplasie à une composante proliférative. Ce projet se situe à l’interface de différentes pathologies : cancer, pathologies cardiovasculaires, immunité/inflammation/infection. En explorant la physiopathologie de la LMMC, il doit aussi générer des approches thérapeutiques nouvelles, les explorer dans des modèles précliniques et les transférer à la clinique grâce aux liens étroits avec l’unité de phase I de Gustave Roussy et les équipes médicales du groupe Francophone des Myélodysplasies.
La transdisciplinarité enrichit notre travail. Nous accueillons dans l’équipe une chercheuse du CNRS Philosophe des Sciences afin d’explorer avec un autre regard la question de l’identité des CSH normales et leucémiques et de l’évolution clonale. Nous avons aussi lancé un essai clinique visant à établir en partenariat un modèle mathématique de production de monocytes qui générera des hypothèses mécanistes et quantitatives pour guider notre recherche biologique.
Des cellules souches hématopoïétiques aux mégacaryocytes
Notre équipe travaille sur l’hématopoïèse normale et pathologique, et notamment sur la mégacaryopoïèse qui est la lignée conduisant à la formation des plaquettes. Nos axes de recherche portent sur :
– la mégacaryopoïèse normale avec l’étude des facteurs de transcription et épigénétiques impliqués dans les différentes étapes de la différenciation
– les pathologies affectant cette lignée : thrombopénies héréditaires ou acquises, thrombocytoses héréditaires ou acquises, notamment via l’étude des néoplasmes myéloprolifératifs
– les mécanismes impliqués dans la progression en leucémies aiguës myéloïdes de certaines de ces pathologies
– des études précliniques dans les néoplasmes myéloprolifératifs et les leucémies aiguës myéloïdes, afin de tester de nouvelles voies thérapeutiques pour améliorer le traitement de ces maladies

Isabelle PLO-AZEVEDO DR2 INSERM (HDR)
Isabelle.PLO@gustaveroussy.fr
et Hana RASLOVA DR2 INSERM (HDR)
Hana.RASLOVA@gustaveroussy.fr
Caroline MARTY CRCN INSERM (HDR)
Iléana ANTONY-DEBRE CRCN INSERM (HDR)
Monika WITTNER CRCN CNRS
William VAINCHENKER DR EMERITE (HDR)
Najet DEBILI DR EMERITE (HDR)
Rémi FAVIER PH APHP
Christine BELLANNE-CHANTELOT MCU-PH
/ Interface INSERM
Florence PASQUIER PH IGR
Jean Baptiste MICOL PH IGR
Christophe MARZAC PH IGR
Delphine MULLER AI INSERM
Nathalie BALAYN TR INSERM
Larissa LORDIER IR (IGR)
Maxime EVRARD Technicien GR
Timothé DENAES IE (GR)
Elodie ROSA IE (INSERM)
Lea DURIX IE (INSERM)
Elisabeth TRY IE (INSERM)
Brahim ARKOUN Post-doc (GR)
Cecilia MARIN-OYARZUN Post-doc (INSERM)
Amandine TISSERAND Thèse 4eme
Camelia BENLABIOD Thèse 4eme
Hélène DUPARC Thèse 3ieme
Suzana DA SILVA BENEDITO Thèse cotutelle 3ieme
Agathe CHEDEVILLE Thèse 2ieme
Jean-Edouard MARTIN Thèse 2ieme
Jean PEGLIASCO Thèse 1ere
Nasrine YAHMI Thèse 1ere
Isabelle LI Master 2 Rose GUIGNARD Master 2
Mario MARINO Master 2 Soumaya
ABDELBAKI Master 2
o Inferring the initiation and development of myeloproliferative neoplasms. Hermange G, Rakotonirainy A, Bentriou M, Tisserand A, El-Khoury M, Girodon F, Marzac C, Vainchenker W, Plo I*, Cournède PH*. Proc Natl Acad Sci U S A. 2022 Sep 13;119(37):e2120374119. doi: 10.1073/pnas.2120374119. Epub 2022 Sep 9.
o An inherited gain-of-function risk allele in EPOR predisposes to familial JAK2V617F myeloproliferative neoplasms. Rabadan Moraes G, Pasquier F, Marzac C, Deconinck E, Damanti CC, Leroy G, El-Khoury M, El Nemer W, Kiladjian JJ, Raslova H, Najman A, Vainchenker W, Marty C, Bellanné-Chantelot C*, Plo I*. Br J Haematol. 2022 Jul;198(1):131-136. doi: 10.1111/bjh.18165. Epub 2022 Mar 30. PMID: 35355248
o Secreted Mutant Calreticulins As Rogue Cytokines in Myeloproliferative Neoplasms. Pecquet C*, Papadopoulos N*, Balligand T*, Chachoua I*, Tisserand A*, Vertenoeil G, Nédélec A, Vertommen D, Roy A, Marty C, Nivarthi H, Defour JP, El-Khoury M, Hug E, Majoros A, Xu E, Zagrijtschuk O, Fertig TE, Marta DS, Gisslinger H, Gisslinger B, Schalling M, Casetti IC, Rumi E, Pietra D, Cavalloni C, Arcaini L, Cazzola M, Komatsu N, Kihara Y, Sunami Y, Edahiro Y, Araki M, Lesyk R, Buxhofer-Ausch V, Heibl S, Pasquier F, Plo I, Vainchenker W, Kralovics R, Constantinescu SN. Blood. 2022 Nov 10:blood.2022016846.
o Stepwise GATA1 and SMC3 mutations alter megakaryocyte differentiation in a Down syndrome leukemia model. Arkoun B, Robert E, Boudia F, Mazzi S, Dufour V, Siret A, Mammasse Y, Aid Z, Vieira M, Imanci A, Aglave M, Cambot M, Petermann R, Souquere S, Rameau P, Catelain C, Diot R, Tachdjian G, Hermine O, Droin N, Debili N, Plo I, Malinge S, Soler E, Raslova H, Mercher T, Vainchenker W. J Clin Invest. 2022 May 19:e156290. doi: 10.1172/JCI156290. Epub ahead of print. PMID: 35587378.
o An inherited gain-of-function risk allele in EPOR predisposes to familial JAK2V617F myeloproliferative neoplasms. Rabadan Moraes G, Pasquier F, Marzac C, Deconinck E, Damanti CC, Leroy G, El-Khoury M, El Nemer W, Kiladjian JJ, Raslova H, Najman A, Vainchenker W, Marty C, Bellanné-Chantelot C, Plo I. Br J Haematol. 2022 Mar 30. doi: 10.1111/bjh.18165. Epub ahead of print. PMID: 35355248.
o Lyl-1 regulates primitive macrophages and microglia development. Wang S, Ren D, Arkoun B, Kaushik AL, Matherat G, Lécluse Y, Filipp D, Vainchenker W, Raslova H, Plo I, Godin I. Commun Biol. 2021 Dec 9;4(1):1382. doi: 10.1038/s42003-021-02886-5. PMID: 34887504; PMCID: PMC8660792.
o Inferring the dynamic of mutated hematopoietic stem and progenitor cells induced by IFNα in myeloproliferative neoplasms. Mosca M, Hermange G, Tisserand A, Noble RJ, Marzac C, Marty C, Le Sueur C, Campario H, Vertenoeil G, El-Khoury M, Catelain C, Rameau P, Gella C, Lenglet J, Casadevall N, Favier R, Solary E, Cassinat B, Kiladjian JJ, Constantinescu SN, Pasquier F, Hochberg ME, Raslova H, Villeval JJ, Girodon F, Vainchenker W, Cournède PH, Plo I. Blood. 2021 Aug 18:blood.2021010986. doi: 10.1182/blood.2021010986. Epub ahead of print.
o Germline ATG2B/GSKIP-containing 14q32 duplication predisposes to early clonal hematopoiesis leading to myeloid neoplasms. Pegliasco J, Hirsch P, Marzac C, Isnard F, Meniane JC, Deswarte C, Pellet P, Lemaitre C, Leroy G, Rabadan Moraes G, Guermouche H, Schmaltz-Panneau B, Pasquier F, Colas C, Benusiglio PR, Bera O, Bourhis JH, Brissot E, Caron O, Chraibi S, Cony-Makhoul P, Delaunay-Darivon C, Lapusan S, de Fontbrune FS, Fuseau P, Najman A, Vainchenker W, Delhommeau F, Micol JB, Plo I, Bellanné-Chantelot C. Leukemia. 2021 Jun 25. doi: 10.1038/s41375-021-01319-w. Epub ahead of print.
o Induced Pluripotent Stem Cells Enable Disease Modeling and Drug Screening in Calreticulin del52 and ins5 Myeloproliferative Neoplasms. Secardin L, Gomez Limia C, da Silva-Benedito S, Lordier L, El-Khoury M, Marty C, Ianotto JC, Raslova H, Constantinescu SN, Bonamino MH, Vainchenker W, Monte-Mor B, Di Stefano A, Plo I. Hemasphere. 2021 Jun 12;5(7):e593. doi: 10.1097/HS9.0000000000000593.
o Dual role of EZH2 on megakaryocyte differentiation. Mazzi S, Dessen P, Vieira M, Dufour V, Cambot M, El-Khoury M, Antony-Debre I, Arkoun B, Basso-Valentina F, Ben Abdelouahab S, Edmond V, Rameau P, Petermann R, Wittner M, Cassinat B, Plo I, Debili N, Raslova H, Vainchenker W. Blood. 2021 Jun 11:blood.2019004638. doi: 10.1182/blood.2019004638. Epub ahead of print.
o CALR mutant protein rescues the response of MPL p.R464G variant associated with CAMT to eltrombopag. Basso-Valentina F, Levy G, Varghese LN, Oufadem M, Neven B, Boussard C, Balayn N, Marty C, Vainchenker W, Plo I, Ballerini P, Constantinescu SN, Favier R, Raslova H. Blood. 2021 May 19:blood.2020010567. doi: 10.1182/blood.2020010567. Epub ahead of print.
o ATG2B/GSKIP in de novo acute myeloid leukemia (AML): high prevalence of germline predisposition in French West Indies. Pegliasco J, Schmaltz-Panneau B, Martin JE, Chraibi S, Khalife-Hachem S, Salviat F, Pasquier F, Willekens C, Lopez M, Ben-Ali A, Bera O, Caron O, Castilla-Llorent C, Cotteret S, Bourdin C, Saada V, Auger N, de Botton S, Vainchenker W, Fuseau P, Helias P, Benabdelali R, Marzac C, Meniane JC, Plo I, Bellanné-Chantelot C, Micol JB.Leuk Lymphoma. 2021 Feb 7:1-8. doi: 10.1080/10428194.2021.1881508. Epub ahead of print.
o JAK2V617F myeloproliferative neoplasm eradication by a novel interferon/arsenic therapy involves PML. Dagher T, Maslah N, Edmond V, Cassinat B, Vainchenker W, Giraudier S, Pasquier F, Verger E, Niwa-Kawakita M, Lallemand-Breitenbach V, Plo I, Kiladjian JJ, Villeval JL, de Thé H. J Exp Med. 2021 Feb 1;218(2):e20201268.
o Calreticulin del52 and ins5 knock-in mice recapitulate different myeloproliferative phenotypes observed in patients with MPN. Benlabiod C, Cacemiro MDC, Nédélec A, Edmond V, Muller D, Rameau P, Touchard L, Gonin P, Constantinescu SN, Raslova H, Villeval JL, Vainchenker W, Plo I, Marty C. Nat Commun. 2020 Sep 28;11(1):4886.
o Different impact of calreticulin mutations on human hematopoiesis in myeloproliferative neoplasms. El-Khoury M, Cabagnols X, Mosca M, Vertenoeil G, Marzac C, Favale F, Bluteau O, Lorre F, Tisserand A, Rabadan Moraes G, Ugo V, Ianotto JC, Rey J, Solary E, Roy L, Rameau P, Debili N, Pasquier F, Casadevall N, Marty C, Constantinescu SN, Raslova H, Vainchenker W, Plo I. Oncogene. 2020 Jul;39(31):5323-5337.
o TET2 haploinsufficiency alters reprogramming into induced pluripotent stem cells. Secardin L, Limia CEG, di Stefano A, Bonamino MH, Saliba J, Kataoka K, Rehen SK, Raslova H, Marty C, Ogawa S, Vainchenker W, Monte-Mor BDCR, Plo I. Stem Cell Res. 2020 Apr;44:101755.
o Germline RUNX1 Intragenic Deletion: Implications for Accurate Diagnosis of FPD/AML. Duployez N, Martin JE, Khalife-Hachem S, Benkhelil R, Saada V, Marzac C, Auger N, Marceau-Renaut A, Favier R, Ballerini P, Caron O, Baruchel A, de Botton S, Preudhomme C, Micol JB, Raslova H, Antony-Debré I. Hemasphere. 2019 Jun 4;3(3):e203.2.
o Disrupted filamin A/αIIbβ3 interaction induces macrothrombocytopenia by increasing RhoA activity. Donada A, Balayn N, Sliwa D, Lordier L, Ceglia V, Baschieri F, Goizet C, Favier R, Tosca L, Tachdjian G, Denis CV, Plo I, Vainchenker W, Debili N, Rosa JP, Bryckaert M, Raslova H. Blood. 2019 Apr 18;133(16):1778-1788.
o Rare type 1-like and type 2-like calreticulin mutants induce similar myeloproliferative neoplasms as prevalent type 1 and 2 mutants in mice. Toppaldoddi KR, da Costa Cacemiro M, Bluteau O, Panneau-Schmaltz B, Pioch A, Muller D, Villeval JL, Raslova H, Constantinescu SN, Plo I, Vainchenker W, Marty C. Oncogene. 2019 Mar;38(10):1651-1660.
